Conţinut
- etape
- Partea 1 Înțelegerea structurii tabelului periodic al elementelor
- Partea 2 Studierea elementelor chimice
- Partea 3 Utilizarea masei atomice pentru a găsi numărul de neutroni
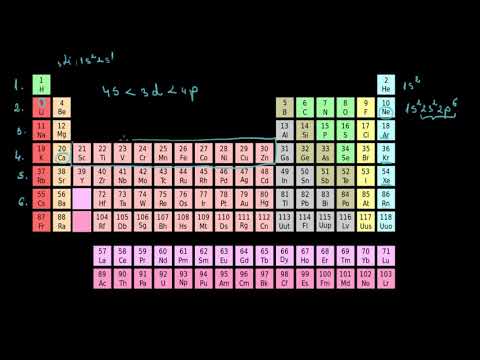
În chimie, tabelul periodic al elementelor este o imagine foarte colorată, cu o mulțime de litere și numere, dar mergeți mai departe și înțelegeți ceva! Totuși, este esențial pentru oricine aspiră să facă studii de chimie. Pe un tabel complet, veți putea citi o mulțime de informații care vă vor permite, de asemenea, să faceți calcule (cum ar fi numărul de neutroni dintr-un nucleu dat) și să rezolvați multe probleme de chimie.
etape
Partea 1 Înțelegerea structurii tabelului periodic al elementelor
-

Știți să citiți tabelul periodic. Elementele sunt sortate, în ordine crescătoare a numerelor atomice, de la dreapta la stânga și de sus în jos. Numărul atomic, deasupra simbolului, este de fapt numărul de protoni care conține un atom al elementului considerat. Și din moment ce protonii au o masă, masa atomică a elementelor crește în aceeași direcție: atomii mai grei (uraniu) sunt în partea de jos, iar cei mai ușori (heliu) sunt în partea de sus.- Dacă masa atomică crește de sus în jos și de la stânga la dreapta, se datorează faptului că aceasta din urmă este suma maselor de protoni și neutroni conținute în nucleele atomilor. Pe măsură ce numărul protonilor crește în tablou, masele atomice cresc și ele.
- Electronii sunt considerați din punct de vedere al masei ca fiind cantități neglijabile în comparație cu cele ale nucleelor.
-

Rețineți că fiecare element are un proton mai mult decât elementul anterior. De aceea, numărul atomic crește de la stânga la dreapta și de sus în jos. Rândurile continuă în rândul inferior din stânga. Veți observa, de asemenea, lacunele din primele trei rânduri.- Primul rând conține doar două elemente, hidrogenul din stânga având un număr atomic de 1 și heliu pe dreapta cu un număr atomic de 2. Sunt îndepărtate deoarece aparțin unor grupuri diferite.
-

Localizați grupurile (sau familiile) elementelor. Toate elementele aceluiași grup sunt pe aceeași coloană, adică 18 grupuri. Fiecare coloană este adesea identificată printr-o singură culoare. A fi din același grup înseamnă a avea proprietăți fizice și chimice similare. Dacă cunoașteți comportamentul unui element în timpul unei reacții, veți putea ghici comportamentul unui element mai puțin obișnuit al aceluiași grup. Toate elementele din aceeași familie au același număr de electroni pe ultimul strat electronic.- Toate elementele aparțin neapărat unei familii chimice. Caz special, hidrogenul nu aparține niciunei serii: acționează la fel de mult ca unul alcalin ca halogen.
- Majoritatea tabelelor indică numărul de familii (de la 1 la 18). Aceste numere sunt indicate cu cifre romane (I) sau cu cifre arabe (1), cu sau fără detalii despre familie (A = familia principală sau B = familia secundară).
- Când citiți o coloană din tabel, vă mutați în cadrul aceluiași grup.
-

Înțelegeți de ce spațiile goale din tablou. Elementele sunt clasificate orizontal după numărul atomic, dar și pe verticală în funcție de structura lor electronică: elementele unei coloane au aceleași proprietăți chimice. Pornind de la aceste două criterii, se dovedește că tabelul prezintă lacune. În cele din urmă, mai mult decât numărul atomic, structura atomilor este cea care explică cel mai bine aceste spații libere.- Numai din elementul 21 apar metalele de tranziție (scandiu, titan ...) care umplu golurile liniilor anterioare.
- Elementele 57 - 102 (lanthanum, ceriu ...) aparțin grupului de pământuri rare și sunt reprezentate de un pătrat mic din tabel, care este detaliat într-un tabel mic din partea de jos a mesei principale.
-

Localizați perioadele. Toate elementele aceleiași linii aparțin unei perioade: toate au același număr de straturi electronice. Numerotarea perioadei corespunde numărului de straturi. potasiu (K) aparține perioadei 4 din cauza acestor patru straturi electronice. Pentru moment, niciun element cunoscut nu are mai mult de 7 straturi electronice.- Pentru a privi doar perioadele extreme, elementele perioadei 1 au un singur strat de electroni și cele ale perioadei 7, șapte.
- Perioadele sunt indicate cel mai adesea în stânga tabelului, dar nu există o regulă fixă.
- Când citiți un rând, vă mutați într-unul singur perioadă.
-

Distingeți între familii de elemente. Astfel, există, printre altele, metale, nemetale și între ele, metale de tranziție. Culorile au fost folosite pentru materializarea acestor grupuri. Pentru a simplifica, să spunem că există trei grupe principale de elemente: metalele (patru subgrupuri) din stânga tabelului, nemetalele (cinci subgrupuri) din dreapta, iar între ele, metalele din tranziție.- În acest tabel, hidrogenul, din motivele prezentate mai sus (un singur proton și un singur neutron), ocupă un loc special și are propria culoare: este neclasificabil, dar este adesea pus în partea stângă sus.
- Metalele sunt acele elemente care au un luciu metalic, sunt solide la temperatura camerei, conduc căldura și electricitatea și sunt maleabile și ductile.
- Elementele nemetalice sunt considerate elemente mate, care nu conduc nici căldură, nici electricitate și nu sunt maleabile. Aceste elemente sunt adesea gaze la temperatura camerei, dar și anumite elemente care, la temperaturi extreme, sunt lichide sau solide.
- Metalele de tranziție au atât proprietățile metalelor, cât și cele ale metalelor.
Partea 2 Studierea elementelor chimice
-

Rețineți că simbolurile au doar una sau două litere. Aceasta este informația care apare cel mai clar în mijlocul fiecărui pătrat. Simbolurile sunt universale, astfel încât toți oamenii de știință să poată comunica. Utilizarea acestor simboluri este esențială în chimie, mai ales când vine vorba de scrierea ecuațiilor de echilibru din experimente.- Simbolurile au fost create de-a lungul timpului și descoperirilor. Cel mai adesea, aceasta este prima sau primele două litere ale numelui elementului. Deci, simbolul hidrogenului este H, în timp ce cel al heliului este elfier, Fe... A doua scrisoare este adesea acolo pentru a evita confuzia cu alte elemente (F, Fe, Fr pentru fluor, fier, franciu).
-

Opțional localizați numele elementului. Pe unele tabele foarte complete, numele elementului (în limba țării de difuzare) este indicat în pătrat. Deci sub simbol C poate fi tipărit numele său: carbonsub Sn : staniu (din latină, SdumneavoastrănNum ).- Unele tabele periodice nu raportează numele elementelor, doar simbolurile.
-

Găsiți numărul atomic al unui element. Adesea plasat în partea de sus a pătratului, nu există nicio regulă cu privire la locația sa. Este întotdeauna bine plasat și adesea în bold pentru că este informație esențială. În prezent, există 118 elemente clasificate.- Numărul atomic este întotdeauna un număr întreg, nu confundați cu celelalte numere ale pătratului, uneori zecimale.
-

Știți care este numărul atomic. Acesta este numărul protonilor conținuți într-un atom dat. Spre deosebire de electronii care pot migra de la un atom la altul, un atom nu poate pierde sau câștiga protoni, decât în fizica nucleară, dar asta este o altă poveste!- Acest număr atomic face, de asemenea, posibil să se calculeze numărul de electroni și neutroni ai unui atom.
-

Știți că fiecare element chimic are la fel de mulți electroni ca protoni. Acest lucru este valabil atât cât atomul nu este ionizat. Protonii au o sarcină pozitivă, în timp ce electronii au aceeași sarcină negativă, cei doi fiind echilibrați în atomi în repaus, dar se poate întâmpla ca în timpul unei reacții chimice, un atom să piardă unul sau mai mulți electroni și în În acest caz, se obțin ioni pozitivi sau negativi.- Ionii au o sarcină electrică. Dacă un ion are mai mulți protoni decât electroni, este un cation (încărcare pozitivă) și se adaugă unul sau mai multe semne de suprascript. Dacă are mai mulți electroni decât protoni, este un anion (sarcină negativă) și se adaugă unul sau mai multe semne - prin expunere.
- Doar ionii poartă mențiunea unei taxe, nu elementele stabile.
Partea 3 Utilizarea masei atomice pentru a găsi numărul de neutroni
-

Găsiți masa atomică. Masa atomică este înscrisă în partea de jos a pătratului elementului, sub simbol. Masa atomică este masa tuturor elementelor care alcătuiesc nucleul unui atom dat, care conține protoni și neutroni. Aceasta se aplică atomilor în repaus. Cu toate acestea, pentru calcularea acestei mase atomice, s-a decis că trebuie să se facă o medie a tuturor maselor atomice ale acestui element în repaus, dar și a celor ale tuturor ionilor săi.- Deoarece aceste mase sunt medii, masele atomice sunt frecvent numere zecimale.
- După cele spuse, ar fi logic ca masele atomice să crească de la stânga la dreapta picturii și de sus în jos, dar aceasta nu este întotdeauna regula.
- Determinați masa atomică relativă a elementului studiat. Se obține prin rotunjirea masei atomice la cel mai apropiat număr întreg. Acest lucru se datorează faptului că masa atomică este o medie a tuturor maselor atomice ale diferitelor forme ale acestui element, inclusiv ioni (de fapt, este chiar mai complicată).
- Astfel, masa atomică de carbon este 12.011, care este în general rotunjită la 12. În mod similar, masa atomică a fierului este 55.847, rotunjită la 56.
-

Calculați numărul de neutroni. Pentru aceasta, este necesar să se elimine numărul de protoni din masa atomică relativă. Masa atomică relativă poate fi rezumată la suma protonilor și neutronilor unui atom, astfel încât, prin cunoașterea numărului de protoni ai unui atom dat, este ușor cu această masă atomică relativă să deducem numărul neutroni!- Folosiți următoarea formulă: numărul de neutroni = masa atomică relativă - numărul de protoni.
- Astfel, carbonul are o masă atomică relativă de 12 și are 6 protoni. Făcând 12 - 6 = 6, deduceți că miezul de carbon conține 6 neutroni.
- Fierul are o masă atomică relativă de 56 și are 26 de protoni. Făcând 56 - 26 = 30, deduceți că miezul de carbon conține 30 de neutroni.
- Izotopii unui element se disting între ei printr-un număr diferit de neutroni, numărul protonilor și electronilor fiind identici. În acest sens, izotopii au toate mase atomice diferite.